臨床試験の報告において「プラセボ」と記載されたものが、実のところ何を指しているのか。どのように製造され、どのように調製されたものか。こうした事柄を明らかにしないことは、その臨床試験の結果の解釈を歪めてしまうことになる。
そんな話題が2019年10月に海外のサイトで話題になりました。
- Poorly reported placebos may lead to mistaken estimates of benefits | オックスフォード大学
- Placebos: what they’re made of matters | The CONVERSATION
- Drug effects hidden by poor placebo reporting | MEDICAL NEWS TODAY
これらは下記の研究報告を受けて出された記事です。
Webster, RK, Howick, J, Hoffmann, T, et al. Inadequate description of placebo and sham controls in a review of recent trials. Eur J Clin Invest. 2019; 00:e13169. https://doi.org/10.1111/eci.13169
プラセボ(対照薬)が解釈を歪める理由
上記サイトでは「オリーブオイル」と「デヒドロコール酸」をプラセボ(対照薬)として利用した臨床試験の解釈が誤る可能性を指摘しています。
有効性が見えなくなる?
かつてオリーブオイル自体にコレステロール低下機能がある事実が知られていなかった時代に、コレステロール低下作用のある医薬品候補化合物の対照薬としてオリーブオイルが採用されていました。
オリーブオイル自体がコレステロールを低下させる場合、オリーブオイルとの比較によって見出される医薬品候補化合物の有効性は低く見積もられてしまう可能性があります。
安全性が大きくなる?
オセルタミビル(タミフル®)の臨床試験では、この医薬品候補化合物の苦みを再現して盲検化するため、デヒドロコール酸を含む対照薬が使用されました。
しかし、デヒドロコール酸には胃腸障害を引き起こす可能性があります。
同様に胃腸障害を引き起こす特性があるオセルタミビルの安全性を評価する際、デヒドロコール酸との比較では胃腸障害が起こる可能性を低く見積もってしまう可能性があります。
プラセボ(対照薬)の詳細は必要不可欠
実際のところ対照薬に何が使用されているかは、有効性や安全性を正確に評価するために必要不可欠な情報となっています。
もし臨床試験で使用されたプラセボ(対照薬)および対照となる介入の内容が明らかにされない場合、その報告内容をどのように解釈しどのように応用できるか、誰にもわからなくなってしまいます。
プラセボの詳細を明確化しない論文に、価値はありません。
プラセボ(対照薬)に関する不十分な説明
プラセボ対照試験を行い、その結果を論文の形で報告する際に明確化すべき事項がガイドラインとして提示されています。
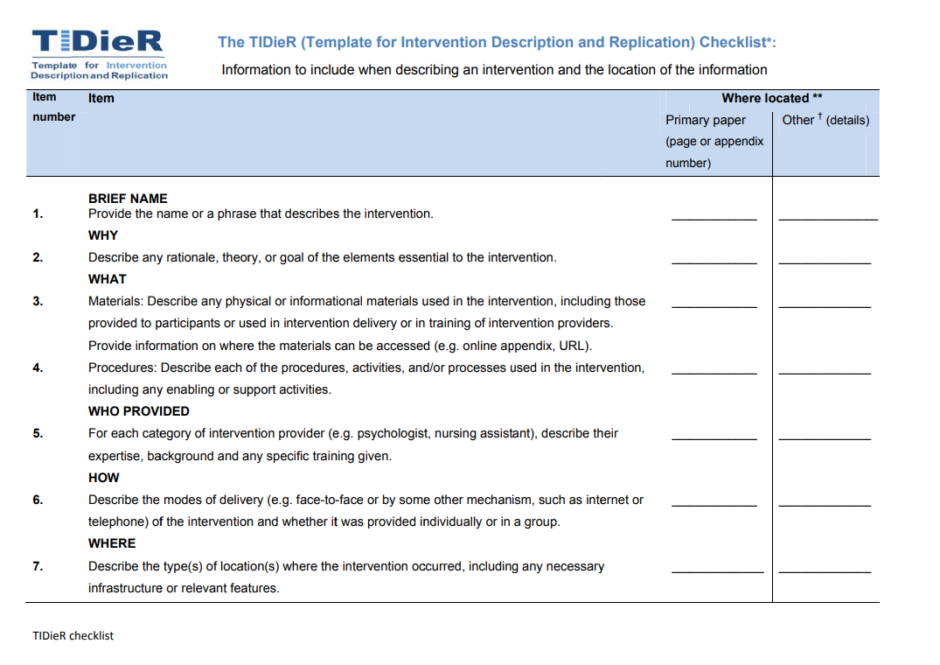
TIDieR
今回話題となった論文では「TIDieR」というガイドラインが紹介されています。
これはランダム化比較試験として実施される臨床試験の報告規程に関して、より大きな枠組みであるCONSORT 2010とSPIRIT 2013の「介入」事項をより具体的に表現したもの。臨床試験の再現性を担保し、知見を実臨床にまで活かすことを目的として作成されたルールです。
臨床試験の結果を報告する論文を作成したり査読したりする場合には12の記載事項を盛り込み・参照しなさい、としています。
下記の英文サイトおよび動画で詳細を確認できます。
TIDieRおよびCONSORT 2010やSPIRIT 2013はいずれも著名な医学雑誌にヒトを対象とした臨床試験を報告する際に参照すべきガイドラインとして位置づけられています。
不十分なTIDieR準拠
さて今回話題となっている論文は、TIDieRがどれほど活用されているか、またTIDieRが偽薬や偽治療の内容をより明確に表記させることにつながったか否かを調査したものです。
Webster, RK, Howick, J, Hoffmann, T, et al. Inadequate description of placebo and sham controls in a review of recent trials. Eur J Clin Invest. 2019; 00:e13169. https://doi.org/10.1111/eci.13169
結果は散々なものでした。医学系のトップジャーナルに掲載された論文を調査対象としたにもかかわらず、プラセボ(偽薬・偽治療)が実のところ何であるのか完全な記載がある論文はなかったのです。
これは「オリーブオイル」や「デヒドロコール酸」の問題が未だ別の形で継続して生じ得ることを意味しています。
プラセボに関する新たな規則を
プラセボといえば何ら効力がなく、摂取しても意味がないもの。
そんな発想が根強く残り、プラセボに関して明確化しない論文があふれる現状を著者らは憂いています。プラセボに何が含まれているのか明らかにされなければ、安全性や有効性を正しく解釈できません。あるいは他者による再現性の確認や実臨床への応用の道も閉ざされてしまいます。
医学系論文の著者、査読者にはTIDieRに準拠する・させる姿勢が求められます。
著者らはさらに、臨床試験において偽薬・偽治療と表現される対照の扱いをよりきちんと説明することを促す新たなガイドラインの開発を推奨しています。